Un volume important de recherche est effectué même lorsqu’il n’existe pas d’incertitudes véritables. Parfois, les chercheurs qui ont fait de réaliser une étude systématique des essais passés des traitements avant d’entreprendre d’autres études ne reconnaissent pas (ou choisissent d’ignorer le fait) que les incertitudes relatives aux effets du traitement ont déjà été prises en compte de façon convaincante. Cela signifie que les personnes qui participent à la recherche se voient parfois refuser un traitement qui pourrait les aider, pour qu’on leur administre un traitement dont il est probable qu’il sera nocif.
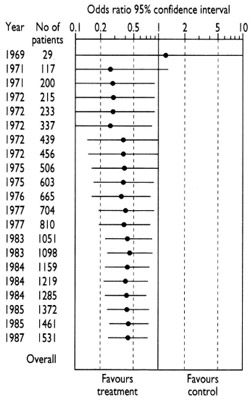
Le diagramme qui accompagne ce paragraphe et le paragraphe suivant illustre l’accumulation des éléments de preuve tirés d’essais contrôlés réalisés pour déterminer si les antibiotiques (par rapport à des placebos inactifs) réduisent le risque de décès postopératoire chez les personnes ayant subi une chirurgie intestinale (Lau et al. 1995). Il est fait mention du premier essai contrôlé en 1969. Les résultats de cette petite étude ne lèvent pas toutes les incertitudes sur l’utilité des antibiotiques – la ligne horizontale représentant les résultats recouvre la ligne verticale qui sépare les effets positifs des effets négatifs des antibiotiques. À juste titre, cette incertitude a été traitée dans le cadre d’autres effets au début des années 70.
À mesure que les éléments de preuve se sont accumulés, toutefois, il est apparu clairement vers le milieu des années 70 que les antibiotiques réduisent les risques de décès après une opération chirurgicale (la ligne horizontale se situe clairement du côté de la ligne verticale montrant les effets positifs du traitement). Pourtant, les chercheurs ont continué à réaliser des études jusqu’à la fin des années 80. La moitié des patients qui ont reçu des placebos au cours de ces études ultérieures se sont ainsi vus refuser une forme de soin dont il avait été démontré qu’il réduisait le risque de décès après leurs opérations. Comment cela a-t-il pu se produire ? C’est probablement parce que les chercheurs ont continué à entreprendre des recherches sans procéder à un examen systématique des éléments de preuve existants. Ce comportement demeure trop courant au sein de la communauté des chercheurs, en partie du fait que certaines des mesures d’incitation dans le monde de la recherche – d’ordre commercial et universitaire – ne font pas passer les intérêts des patients en premier (Chalmers 2000).
Les patients et les participants à ces activités de recherche peuvent également souffrir du fait que les chercheurs n’ont pas systématiquement examiné les éléments de preuve pertinents tirés de la recherche animale avant d’entamer des essais sur les hommes. Une équipe néerlandaise a passé en revue l’expérience tirée d’essais réalisés sur plus de 7 000 patients pour un nouveau médicament anti-calcique administré à des personnes ayant eu une attaque cérébrale. Ils n’ont trouvé aucun élément factuel appuyant un accroissement de son utilisation dans la pratique (Horn et Limburg 2001). Cela les a amenés à s’interroger sur la qualité et les conclusions de la recherche animale qui avait donné lieu à la recherche sur les patients. Leur examen des études animales a révélé que celles-ci n’avaient jamais suggéré que ce médicament serait utile pour l’homme (Horn et al. 2001).
Le plus souvent, si la recherche de traite pas des incertitudes véritables, c’est simplement parce que les chercheurs n’ont pas la discipline suffisante pour examiner les éléments de preuve existants pertinents de façon systématique avant d’entreprendre de nouvelles études. Il arrive cependant que les raisons de ce phénomène soient plus sinistres. Les chercheurs peuvent être informés des éléments de preuve existants mais ils souhaitent concevoir des études de façon à s’assurer que leurs propres recherches donnent des résultats favorables pour des traitements particuliers. Habituellement, mais ce n’est pas toujours le cas, c’est pour des raisons commerciales (Djulbegovic et al. 2000 ; Sackett et Oxman 2003). Ces études sont délibéremment conçues pour constituer des essais non fiables de traitements. Ce résultat peut être obtenu en omettant un traitement de comparaison connu pour aider les patients (comme dans l’exemple ci-dessus), ou en administrant les traitements de comparaison à des doses trop faibles (de sorte qu’ils ne fonctionnent pas bien), ou à des doses trop élevées (de sorte qu’ils ont davantage d’effets secondaires) (voir le commentaire de Mann et Djulbegovic). Cela peut aussi résulter d’un suivi des patients sur une période trop courte (qui ne permet pas de détecter les effets tardifs des traitements), et de l’utilisation de mesures de résultats (‘éléments auxiliaires’) qui n’ont que peu, voire pas de corrélation avec les résultats qui importent pour les patients.
Les lecteurs du présent essai peuvent être surpris d’apprendre que les comités d’éthique de la recherche mis en place ces dernières décennies pour veiller au caractère éthique de la recherche n’ont eu que peu d’influence sur ces fautes dans le domaine de la recherche. La plupart de ces comités ne se sont pas acquittés de leurs responsabilités envers ceux qu’ils auraient dû protéger dans la mesure où ils n’ont pas obligé les chercheurs et les sponsors cherchant à obtenir l’approbation de nouveaux essais à examiner les éléments de preuve systématiquement (Savulescu et al. 1996 ; Chalmers 2002). Le fait que les comités d’éthique de la recherche n’aient pas su protéger les patients et le public de façon efficace à cet égard souligne bien à quel point il est important d’améliorer les connaissances générales sur les caractéristiques des essais contrôlés des traitements médicaux.