Se sigue llevando a cabo una buena cantidad de investigación aún cuando no exista una incertidumbre genuina. Los investigadores que no realizan revisiones sistemáticas de las pruebas pasadas de los tratamientos antes de embarcarse en nuevos estudios a veces no reconocen (o prefieren ignorar) que las dudas sobre los efectos del tratamiento ya han sido tratadas de manera convincente. Esto significa que, a veces, se les niega a las personas que participan en la investigación un tratamiento que podría ayudarlas o se les da un tratamiento que probablemente las perjudique.
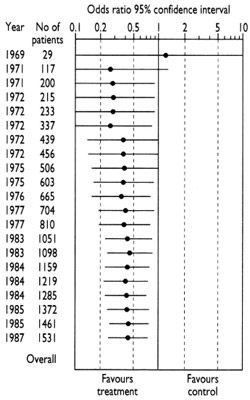 En el diagrama que acompaña a este párrafo y al siguiente se muestra la evidencia acumulada correspondiente a pruebas auténticas realizadas para evaluar si los antibióticos (en comparación con los placebos inactivos) reducían el riesgo de muerte posoperatoria en personas con cirugía de intestino (Lau et al. 1995). La primera prueba auténtica se informó en 1969. Los resultados de ese pequeño estudio dejaron dudas sobre si los antibióticos eran o no útiles: la línea horizontal que representa los resultados cruza la línea vertical que separa los efectos favorables de los antibióticos de los no favorables. Con razón, esta incertidumbre volvió a ser tema de estudio en otras pruebas a principios de la década de 1970.
En el diagrama que acompaña a este párrafo y al siguiente se muestra la evidencia acumulada correspondiente a pruebas auténticas realizadas para evaluar si los antibióticos (en comparación con los placebos inactivos) reducían el riesgo de muerte posoperatoria en personas con cirugía de intestino (Lau et al. 1995). La primera prueba auténtica se informó en 1969. Los resultados de ese pequeño estudio dejaron dudas sobre si los antibióticos eran o no útiles: la línea horizontal que representa los resultados cruza la línea vertical que separa los efectos favorables de los antibióticos de los no favorables. Con razón, esta incertidumbre volvió a ser tema de estudio en otras pruebas a principios de la década de 1970.
Sin embargo, a medida que se fue acumulando evidencia, a mediados de la década de 1970 quedó claro que los antibióticos reducen el riesgo de muerte después de la cirugía (la línea horizontal cae francamente del lado de la línea vertical que favorece al tratamiento). Aún así, los investigadores continuaron con los estudios hasta fines de la década de 1980. Por lo tanto, a la mitad de los pacientes, que recibieron placebos en estos últimos estudios, se les negó una forma de atención médica para la que ya se había demostrado que reducía el riesgo de muerte después de sus operaciones. ¿Cómo pudo suceder esto? Probablemente porque los investigadores continuaron embarcándose en nuevas investigaciones sin revisar sistemáticamente la evidencia que ya existía. Este comportamiento continúa siendo demasiado común en la comunidad investigadora, en parte debido a que algunos de los incentivos en el mundo de la investigación —comerciales y académicos— no anteponen los intereses de los pacientes (Chalmers 2000).
 Los pacientes y los participantes en la investigación también pueden sufrir debido a que los investigadores no han revisado sistemáticamente la evidencia pertinente obtenida de la investigación en animales antes de comenzar a probar los tratamientos en humanos. Un equipo holandés revisó la experiencia de más de 7000 pacientes que habían participado en pruebas de un nuevo bloqueante de calcio administrado a personas con accidente cerebrovascular y no encontraron ninguna evidencia que respaldara su uso, cada vez mayor, en la práctica (Horn y Limburg 2001). A raíz de esto, se preguntaron acerca de la calidad y los hallazgos de la investigación en animales sobre la que se había basado la investigación en los pacientes. La revisión de los estudios realizados en animales reveló que sus resultados jamás habían sugerido que el fármaco pudiera ser útil en los humanos (Horn et al. 2001).
Los pacientes y los participantes en la investigación también pueden sufrir debido a que los investigadores no han revisado sistemáticamente la evidencia pertinente obtenida de la investigación en animales antes de comenzar a probar los tratamientos en humanos. Un equipo holandés revisó la experiencia de más de 7000 pacientes que habían participado en pruebas de un nuevo bloqueante de calcio administrado a personas con accidente cerebrovascular y no encontraron ninguna evidencia que respaldara su uso, cada vez mayor, en la práctica (Horn y Limburg 2001). A raíz de esto, se preguntaron acerca de la calidad y los hallazgos de la investigación en animales sobre la que se había basado la investigación en los pacientes. La revisión de los estudios realizados en animales reveló que sus resultados jamás habían sugerido que el fármaco pudiera ser útil en los humanos (Horn et al. 2001).
La razón principal por la que la investigación no aborda incertidumbres genuinas es que los investigadores sencillamente no tienen la disciplina suficiente para revisar la evidencia pertinente de manera sistemática antes de iniciar nuevos estudios. Sin embargo, a veces las razones son más siniestras. Es posible que los investigadores sí conozcan la evidencia existente pero quieran diseñar estudios para asegurarse de que su propia investigación generará resultados favorables para determinados tratamientos. En general, aunque no siempre, los impulsan razones económicas (Djulbegovic et al. 2000; Sackett y Oxman 2003). Estos estudios están deliberadamente diseñados para constituirse en pruebas no auténticas de los tratamientos: esto puede lograrse reteniendo un tratamiento de comparación que, se sabe, ayuda a los pacientes (como en el ejemplo anterior) o administrando tratamientos de comparación en dosis inadecuadamente bajas (de manera que no funcionen tan bien) o en dosis inadecuadamente elevadas (de manera que causen efectos secundarios no deseados) (vea el comentario de Mann y Djulbegovic), y también puede ser el resultado de un seguimiento demasiado breve de los pacientes (que deja de lado los efectos retardados de los tratamientos) y de utilizar medidas de resultados (“sustituciones”) que tengan muy poca o ninguna correlación con los resultados que importan a los pacientes.
Quizá sorprenda a los lectores de este ensayo que los comités de ética establecidos durante las últimas décadas para garantizar que la investigación sea ética hayan hecho tan poco para modificar esta mala práctica en la investigación. La mayoría de estos comités han defraudado a las personas que debían haber protegido porque no les han exigido a los investigadores y los patrocinadores que pidieron la autorización para nuevas pruebas que revisaran sistemáticamente la evidencia ya existente (Savulescu et al. 1996; Chalmers 2002). El fracaso de los comités de ética en la investigación en su tarea de proteger eficientemente a los pacientes y al público en su totalidad pone de manifiesto la importancia de aumentar el conocimiento general sobre las características que hacen que una prueba de un tratamiento médico sea auténtica.